25 شهریور استفاده از روش الایزا (ELISA) در اندازهگیری و سنجش HCP
اندازه گیری و سنجش HCP با استفاده از روش الایزا (ELISA)
داروهای زیستی نوترکیب بخش بزرگی از فروش جهانی دارو را به خود اختصاص دادهاند. برای اطمینان از سطوح بالای ایمنی در طول آزمایشات بالینی و پس از عرضه محصول دارویی، مقررات متعددی توسط نهادهای نظارتی مختلف مانند FDA و EMA تدوین شده است. درخواست مجوز جهت عرضه دارو مستلزم یک ارزیابی کلی از خطرات و مزایای بالقوه و ویژگیهای کیفیت حیاتی (Critical quality attributes; CQA) است. پروتئینهای سلول میزبان (HCPs) یکی از این CQAها هستند. HCPها مخلوط پیچیدهای از پروتئینها با خواص فیزیکی و ایمونولوژیکی مختلف را تشکیل میدهند و در طول تولید محصول بیولوژیکی توسط رده سلولی تولیدکننده محصول آزاد میشوند.
HCPها که به عنوان ناخالصیهای دارویی مرتبط با فرایند تعریف میشوند، میتواند بر کیفیت، ایمنی و کارایی یک محصول دارویی بیولوژیکی تأثیر منفی بگذارند. بنابراین نیاز به نظارت دقیق و کاهش HCP در طول پردازش گام به گام مراحل پاییندست (DSP) وجود دارد تا مقادیر کم HCP را برطرف کند. اگرچه مقادیر دقیقی برای میزان مجاز HCP مشخص نشده است، اما طبق توافق صورت گرفته، میزان HCP در ماده دارویی نهایی باید زیر ppm100 و به ازای هر دوز دارو زیر 10ng باشد.
تشخیص دقیق ناخالصیهای HCP در مراحل پایین دست تا ماده نهایی دارویی به میزان زیادی به ایجاد یک روش قابل اعتماد و قوی برای اندازهگیری HCP بستگی دارد. برای دستیابی به این امر، استفاده از روشهای تحلیل HCP چندوجهی توصیه میشود. سنجش مبتنی بر روش الایزا (ELISA) هنوز به عنوان استاندارد طلایی برای اندازه گیری HCP در نظر گرفته میشود و دارای مزایایی مانند سرعت بالا، حساسیت و توان عملیاتی بالا است.
انتخاب ELISA مناسب جهت شناسایی HCP
HCP-ELISA برای کمیسازی HCP را میتوان به سه فرمت اصلی تقسیم کرد:
- HCP-ELISA عمومی که به آن HCP-ELISA تجاری نیز میگویند.
- پلتفرم HCP-ELISA (یا چند محصولی).
- HCP-ELISA اختصاصی فرایند.
در HCP-ELISA عمومی از یک رویکرد پوشش آنتیبادی فعال به طور گسترده استفاده میشود، که فقط مختص رده سلولی تولیدکننده پروتئین نوترکیب خاص است. در حالیکه، دو فرمت دیگر HCP-ELISA دارای اختصاصیت بیشتری برای داروهای زیستی خاص هستند. اینکه کدام HCP-ELISA برای استفاده در کدام مرحله از توسعه یک داروی کاندید بهتر است تاکنون روشن نشده است.
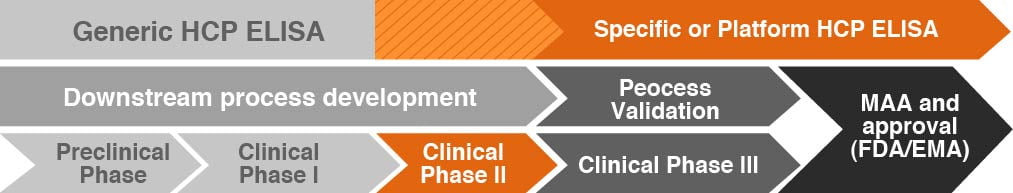
برای تولید دارو، تمام فرایندها از جمله استفاده از روشهای تحلیلی نیاز به اعتبارسنجی دارند. اگر در این مرحله تغییراتی در مراحل ساخت انجام شود، اعتبار سنجی فرآیند باید مجددا تکرار شود تا زمانی که سازگاری کافی حاصل شود. رایجترین توصیه این است که در طول توسعه روش، باید تنها به یک ELISA عمومی گسترده اعتماد کرد.
هنگامی که به سمت آزمایشهای بالینی در فازهای II و III حرکت میکنیم، اجرای یک ELISA ویژه فرایند معمولاً برای نظارت بر HCP کافی است و اجازه میدهد معیارهای اعتبارسنجی سنجش برآورده شود. استفاده از یک پلتفرم HCP-ELISA زمانی کافی است که شرایط تولید، شرایط پایین دست و ماهیت اصلی بیوداروهای مختلف فقط اندکی متفاوت باشد، بدون اینکه تأثیر عمده ای بر الگوی HCP مربوطه داشته باشد. با این حال، باید در نظر گرفته شود که یک HCP-ELISA عمومی ممکن است در طول چرخه یک داروی زیستی بصورت محدودی در دسترس باشد.
طراحی دقیق آزمون های عملکردی
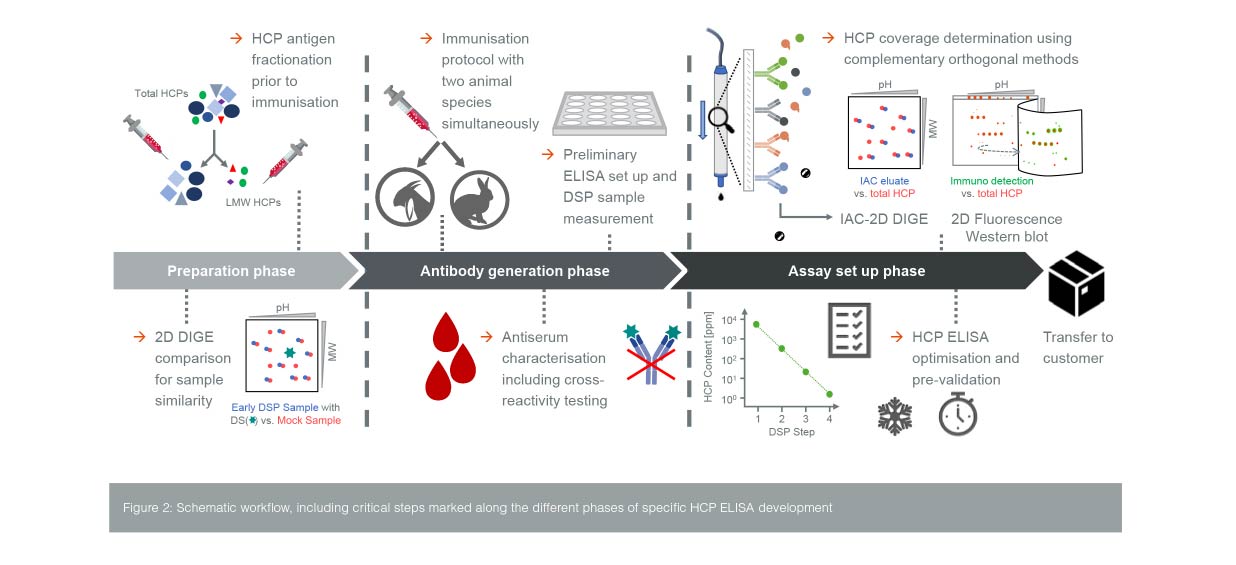
مناسب بودن HCP-ELISA برای نظارت بر HCP معمولاً با استفاده از یکسری معیارهای عملکردی تعیین میشود. سنجش مورد استفاده باید بتواند مقادیر بسیار کم HCP در نمونه را حتی در نمونههایی با خلوص بالا ردیابی کند بهطوریکه میزان HCP در طول مراحل پایین دستی کاهش لگاریتمی داشته باشد. همچنین در رقتهای بالا بصورت خطی باشد. از طرفی پوشش آنتیبادی اختصاصی HCP کافی باشد. یکی از عوامل حائز اهمیت در تولید آنتی بادی های اختصاصی HCP، انتخاب HCP صناعی مناسب برای تولید آنتیبادی پلی کلونال (pAb) جهت توسعه HCP-ELISA است. در حالت ایدهآل، شباهت زیاد در طیف HCP صناعی و نمونه HCP که از فرایند تولید مواد دارویی نوترکیب نشات میگیرد، برای تولید pAb لازم است. برای بررسی شباهت میتوان از فناوری الکتروفورز ژل افتراقی دو بعدی (DIGE) استفاده کرد. در اینجا، الگوی نقطه ای HCP یک نمونه مواد دارویی اولیه تولیدی از نظر کیفی با الگوی یک نمونه صناعی معین مقایسه میشود.
یکی از عوامل موثر در ایجاد HCP، وزن مولکولی آن میباشد. HCP با وزن مولکولی پایین (LMW) قدرت ایمنیزایی کمتری دارد. بنابراین جمعیت آنتیبادیهای اختصاصی تولید شده علیه آنها کمتر خواهد بود. پانل آنتیبادی پلی کلونال (pAb) را میتوان با استفاده از دوگونه حیوانی میزبان مختلف (بز و خرگوش) برای ایمن سازی ایجاد کرد. پاسخ ایمنی اختصاصی HCP در حیوانات منفرد با تعیین تیتر ELISA و وسترن بلات کنترل میشود. همچنین آزمایش آنتی سرم برای تعیین واکنش متقاطع در برابر ماده دارویی (DS)، به منظور حذف نتایج مثبت کاذب HCP-ELISA در طول تجزیه و تحلیل نمونه فرایند صورت میگیرد. سپس یک ELISA اولیه با آنتیبادیهای خالصشده با میل ترکیبی مناسب صورت میگیرد و عملکرد آن ارزیابی میشود. از این میان، گونهای که به بهترین وجه با معیارهای کیفیت مطابقت دارد، برای ایمنسازی طولانیمدت و متعاقب آن خالصسازی آنتیبادی در مقیاس بزرگ انتخاب میشود.
ارزیابی خصوصیات معرف برای صلاحیت HCP-ELISA
یکی از ارزیابیهای صورت گرفته برای تعیین مناسب بودن HCP-ELISA جهت پایش HCP، شامل پوشش آنتیبادی اختصاصی HCP است. آنالیز پوشش برای تعیین نسبت گونههای HCP که با موفقیت توسط pAb شناسایی شدهاند انجام میشود و به صورت درصد پوشش HCP بیان میشود. روش رایج وسترن بلات دو بعدی است که از مواد صناعی HCP و/یا نمونه اولیه DSP استفاده میکند. یکی دیگر از این روشها استفاده از کروماتوگرافی ایمونوافینیتی (IAC) با استفاده از pAb بی حرکت و به دنبال آن DIGE دو بعدی است. در DIGE دو بعدی از کسر HCP متصل به pAb با کل نمونه HCP امکان تخمین پوشش HCP توسط آنتیبادیها در شرایط غیر دناتورهکننده فراهم میشود. با این حال، هر دو رویکرد آنالیز با محدودیتهای قابلتوجهی همراه هستند.
برای دستیابی به یک تخمین علمی معتبر از پوشش HCP، استفاده از هر دو روش به شدت توصیه میشود. همانطور پیشرفت در طیف سنجی جرمی ممکن است به ارزیابی پوشش HCP کمک کند. اخیراً، ترکیبهای جالبی از روشهای طیفسنجی ایمونوافینیتی و طیف سنجی جرمی پیشنهاد شدهاند، مانند خالصسازی مبتنی بر میل ترکیبی Bead antibody یا ELISA-MS. باید دید که این روشها با چه سرعتی به عنوان ابزارهای تحلیلی برای تعیین پوشش تکمیلی در آینده پذیرفته خواهند شد.
Source:
.Elisa T, Elisa HCP. Making the Right Choices for Reliable HCP Monitoring by ELISA. Eur Biopharm Rev. 2021;(January):60–3.




No Comments