
14 شهریور ناخالصی داروهای نوترکیب
بیو دارو چیست؟
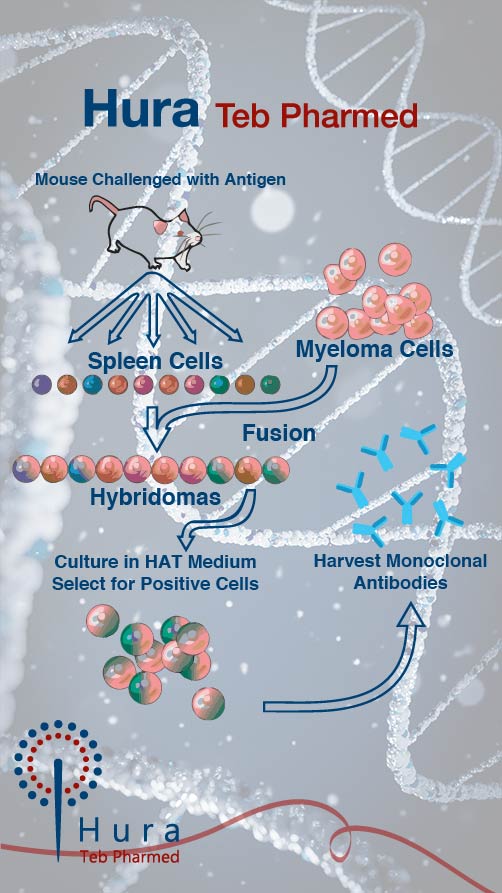
اصطلاح بیو داروها یا داروهای نوترکیب در دهه 1980 ابداع شد و به داروهای تولید شده در فرایندهای بیوتکنولوژی با استفاده از روش زیستشناسی مولکولی اشاره دارد. برخی از این داروها مانند آنتیبادیهای مونوکلونال مولکولهای خاصی را هدف قرار میدهند، به زبان ساده مانند موشک نقطه زن بادقت بالا عمل میکنند و در درمان طیف گستردهای از بیماریها از جمله سرطان، اختلالات متابولیک و… استفاده میشود. از جمله داروهای تولید شده نوترکیب در ایران میتوان به آنتیبادیهای مونوکلونال ضد HER2 سرطان پستان اشاره کرد.
در تولید داروهای نوترکیب از سلولهای میزبان مانند باکتری اشریشیا کلای (E. Coli)، سلولهای تخمدان همستر چینی (CHO)، حشرات (سلولهایSf9)، یا حتی گیاه (تنباکو) استفاده میشود.
تولید داروهای زیستی
تولید یک داروی زیستی مانند یک آنتیبادی مونوکلونال (mAb) شامل مراحل مختلفی است که معمولاً به بالادستی و پاییندستی تقسیم میشوند.
فرایند بالادستی:
بهتمامی فرایندهای جداسازی اولیه سلول و کشت تا نگهداری سلولها و توسعه کشت آنها و در آخر، برداشت نهایی (پایان کشت و جمعآوری سلولها) گفته میشود که طی آن سلولهایی مانند باکتریها و ردههای سلولی پستانداران در فرمانتور و بیورآکتور رشد میکنند. فرایند بالادستی شامل تمام مراحل مرتبط با توسعه تلقیح، بهبود فرمولاسیون محیط کشت، بهبود میزان تولید محصول بوسیله فرایندهای مهندسی ژنتیک و بهبود سینیتیک رشد است.
 آنتیبادی مونوکلونال
آنتیبادی مونوکلونال
فرایند پاییندستی:
بخش پاییندستی یک زیست فرایند، به قسمتی گفته میشود که طی آن، توده سلولی حاصل از مراحل بالادست برای دستیابی به کیفیت و خلوص لازم پردازش میشود. فرایند پاییندستی به سه بخش اصلی تقسیم میشود: ۱. تخریب سلول ۲. خالصسازی ۳. پرداخت
 ناخالصی داروهای نوترکیب
ناخالصی داروهای نوترکیب
ناخالصی داروهای نوترکیب
در طول تولید و توسعه داروهای نوترکیب پروتئینهای سلول میزبان بهعنوان ناخالصی شناسایی میشوند و ممکن است در مراحل مختلف باقی بماند. همچنین ناخالصیهای شیمیایی در ترکیب پروتئینی میتواند موجب بلوکه شدن و یا اختلال عملکرد پروتئین اصلی شده و پتانسیل درمانی یا بازده دارو را در بدن بیمار بهشدت کاهش دهند. همینطور ممکن است برخی از ناخالصیها عملکرد پروتئین درمانی را به نحو غیرقابلکنترلی افزایش داده و برای مصرفکننده خطرساز شوند.
برخی از ناخالصیها مانند پروتئینهای سلول میزبان یا Host cell proteins، میتوانند تحریککننده سیستم ایمنی بوده و یا با رفتاری مشابه ادجوانها (adjuvant) ، سلولهای ایمنی میزبان را نسبت به پروتئین درمانی تحریک کرده و موجب خنثیشدن ترکیب دارویی در بدن بیمار بهواسطه سیستم ایمنی شوند.
پروتئینهای سلول میزبان (Host Cell Proteins) همچنین میتوانند شامل آنزیمهایی مانند اکسیداز و لیپاز باشند و پروتئین درمانی را در طی گذشت زمان تخریب کرده و موجب کاهش پایداری ترکیب دارویی شوند. علاوه بر این، ناخالصی از نوع پروتئینهای سلول میزبان میتواند در مراحل ارزیابی عملکردی دارو نیز اختلال ایجاد کرده و در این تستها فعالیت پروتئین اصلی را تقلید کنند، در نتیجه باعث ایجاد خطا در فرمولاسیون دارویی شوند. ضروری است که میزان HCPها به حداقل برسد.
روشهای تشخیص HCP
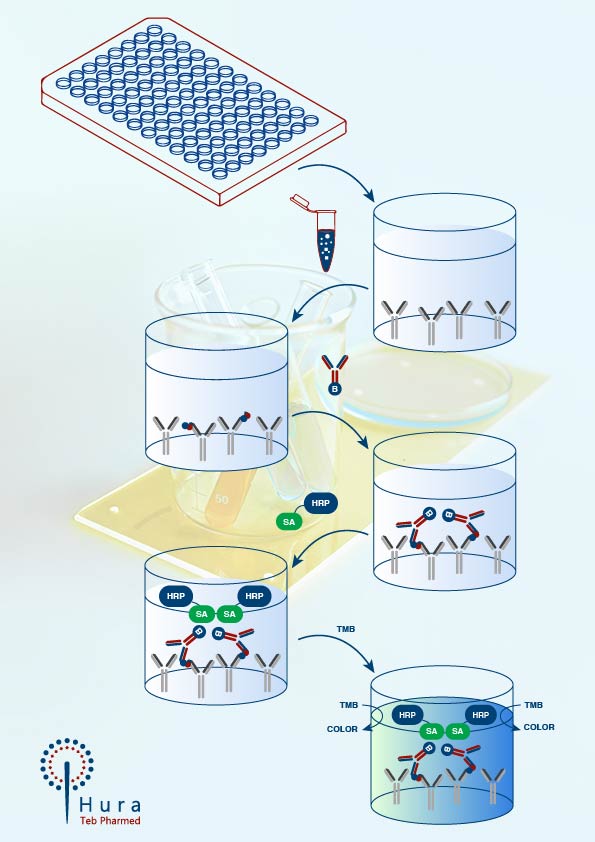
روش الایزا: تا سالهای اخیر روش الایزا تنها روش برای تشخیص ناخالصیها بود. استفاده از روش الایزا چندین مزیت دارد:
حساسیت بالا، دردسترسبودن، توانایی عملیاتی و گزینشپذیری بالا
کیفیت الایزا به عوامل متعددی متکی است، از جمله مهمترین اجزای روش الایزا استفاده از آنتیبادیهای مناسب در این تست است که تولید این آنتیبادیها به روش تهیه آنتیژن از رده سلولی میزبان، انتخاب گونههای حیوانی برای ایمنسازی، پاسخهای ایمنی فردی حیوانات بستگی دارد.
 کیتهای تشخیص پروتئین سلول میزبان الایزا
کیتهای تشخیص پروتئین سلول میزبان الایزا
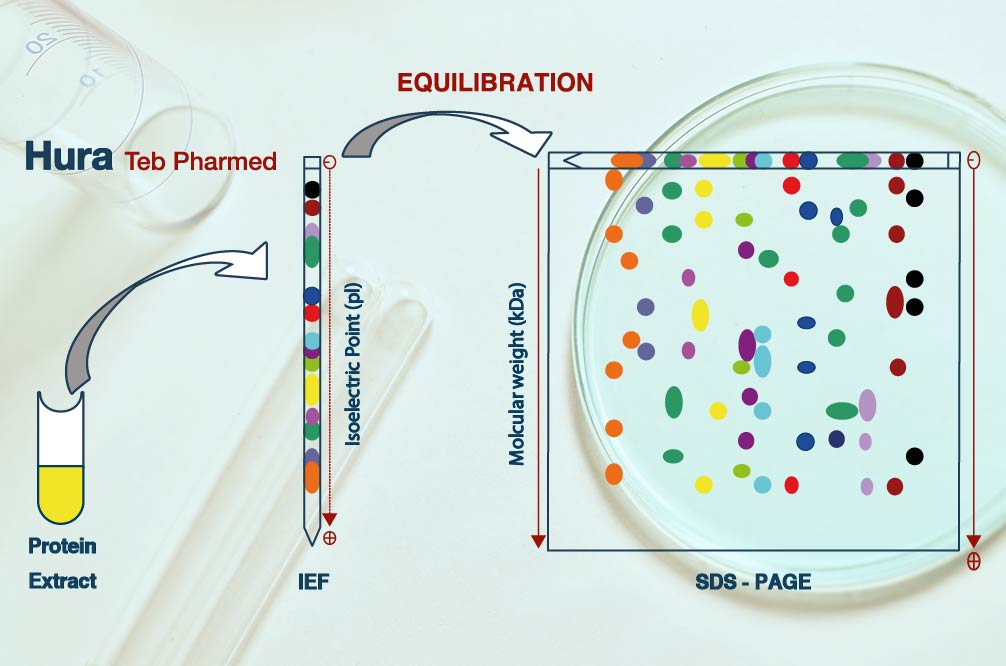
روش الایزا باید قادر به شناسایی، یعنی پوششدادن اکثر HCPهایی باشد که به طور بالقوه در نمونههای دارویی فرایندی و نهایی یافت میشوند. متداولتری روشهای پوشش هنگام استفاده از پوشش آنتیبادی HCP بر اساس تکنیکهای الکتروفورز ژل، تعداد لکههای ناخالصیهای پروتئینی در ژل، که پس از رنگآمیزی با آنتی بادی پلی کلونال کونژوگه با آنزیم مشاهده میشود، با تعداد لکههای مشاهده شده پس از رنگآمیزی پروتئین کل مانند نیترات نقره یا کوماسی بلو با هم مقایسه میشود. این تکنیکها دارای محدودیتهای متعددی هستند که منجر به تغییرات بالایی در درصد پوشش HCP میشود، مانند انتقال بیشازحد از طریق غشاء یا انتقال ناقص HCPs به غشای بلات، شمارش نقطهای غیرقابلاعتماد یا محاسبه یک HCP برای چندین نقطه و بارگذاری بیشازحد یا رفتوآمد در جایی که ممکناست یک نقطه روی نقطه دیگر قرار گیرد. مشکلات در مقایسه لکهها در بلات و ژل از روشهای متفاوت رنگآمیزی با حساسیتهای مختلف و شرایط دناتوره در طول الکتروفورز ژل دوبعدی که اپی توپهای دست نخورده را از بین میبرد، منشا میگیرد. علاوه بر این، روشهای پوشش مبتنی بر ایمونوافینیتی به مقادیر زیادی آنتیبادی ضد HCP نیاز دارند، که ممکن است یک عامل محدودکننده باشد زیرا آنتیبادی HCP باید در طول عمر مورد انتظار محصول همواره در دسترس باشد. روشهای پوشش جدید، ترکیبی از تخلیص ایمنی بر روی دانههای مغناطیسی یا در یک صفحه ELISA، باLC-MS ، اخیراً توصیف شدهاند این روشها حساسیت بالایی را با شناسایی و تعیین کمیت HCPهای فردی توسط LC-MS نشان میدهند. چالشهای روشهای پوشش جدید متکی به LC-MS این است که در مقایسه با تجهیزات ژل و بلات که معمولاً مورد استفاده قرار میگیرند، به ابزارهای طیف سنجی جرمی پیچیده و گران قیمتی نیاز دارند و در صورتی که توسط تریپسین هضم نشوند، ممکن است برخی از HCPها را کمتر نشان دهند. پوشش ناکافی HCP-ELISA ممکن است منجر به نیاز به روشهای متعامد (orthogonal) مانند LC-MS برای تجزیه و تحلیل HCP به عنوان ابزار ارزیابی اولیه HCP یا پشتیابی شود.
 Equilibration
Equilibration
در حالت ایدهآل، سنجشهای HCP باید این قابلیت را داشته باشند که تمام HCPها را بهصورت کمی با روشی با کارایی بالا شناسایی کنند. بااینحال، باتوجهبه پیچیدگی و تعداد HCPهای بالقوهای که میتوانند در محصول دارویی خالص شده وجود داشته باشد، هنوز نمیتوان این الزامات را با یک فناوری واحد برآورده کرد. تجزیهوتحلیل سنتی HCP توسط الایزا یک ابزار مهم برای نظارت بر HCPs تحریککننده ایمنی (Immunoreactive) است.
سنجش الایزای HCP حساسیت بالایی دارد و حد تشخیص آن حدود 1 ppm است که نسبتاً بهراحتی در آزمایشگاهها قابل انجام است. نقص اصلی آن عدم شناسایی و تعیین کمی HCPهای منحصربهفرد و ریسک ازدستدادن HCPهای غیرتحریککننده ایمنی است. روش آنالیز LC-MS کمی توانایی شناسایی HCPهای بالقوه نگرانکننده و شناسایی HCPهایی که با روش الایزای HCP پوشش داده نمیشوند را دارد.
ترکیبی از روشهای تجزیهوتحلیل HCP امکان ارزیابی بسیار حساس از خلوص محصول در طول توسعه و افزایش دانش فرایند را فراهم میکند. این امر توسعهدهندگان فرایند را قادر میسازد تا استحکام فرایند را بهبود بخشند و ارزیابی کنند تا محصولات ثابتی را برای بیماران ارائه دهند و ارزیابی ریسک مرتبط باکیفیت محصول را طبق دستورالعملهای نظارتی انجام دهند. تجزیهوتحلیل دقیق پوشش HCP مبتنی بر MS و شناسایی مستقیم و کمیت HCPهای منحصربهفرد توسط LC–MS یک استراتژی نظارت بر HCP را بر اساس فناوری الایزا همراه با آنالیز متعامد LC-MS امکانپذیر میکند. نظارت بهبودیافته HCP منجر به ارتقای سنجش و شناسایی HCP میشود که در انتها هم برای صنعت داروسازی و هم برای ایمنی بیمار مفید است.
منابع:
Pilely, K., Johansen, M.R., Lund, R.R. et al. Monitoring process-related impurities in biologics–host cell protein analysis. Anal Bioanal Chem 414, 747–758 (2022). https://doi.org/10.1007/s00216-021-0364
Kesik-Brodacka M. Progress in biopharmaceutical development Biotechnology and Applied Biochemistry.306–322 (2017). https://doi.org/:10.1002/bab.1617




No Comments